
Tất cả nội dung của iLive đều được xem xét về mặt y tế hoặc được kiểm tra thực tế để đảm bảo độ chính xác thực tế nhất có thể.
Chúng tôi có các hướng dẫn tìm nguồn cung ứng nghiêm ngặt và chỉ liên kết đến các trang web truyền thông có uy tín, các tổ chức nghiên cứu học thuật và, bất cứ khi nào có thể, các nghiên cứu đã được xem xét về mặt y tế. Lưu ý rằng các số trong ngoặc đơn ([1], [2], v.v.) là các liên kết có thể nhấp vào các nghiên cứu này.
Nếu bạn cảm thấy rằng bất kỳ nội dung nào của chúng tôi không chính xác, lỗi thời hoặc có thể nghi ngờ, vui lòng chọn nội dung đó và nhấn Ctrl + Enter.
Ung thư phổi
Chuyên gia y tế của bài báo
Đánh giá lần cuối: 12.07.2025
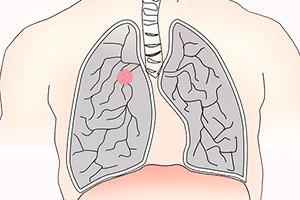
Ung thư phổi là khối u ác tính ở phổi, thường được phân loại là tế bào nhỏ hoặc không phải tế bào nhỏ. Hút thuốc lá là yếu tố nguy cơ chính đối với hầu hết các loại khối u. Các triệu chứng bao gồm ho, khó chịu ở ngực và ít gặp hơn là ho ra máu, nhưng nhiều bệnh nhân không có triệu chứng và một số phát triển các tổn thương di căn. Chẩn đoán được nghi ngờ bằng chụp X-quang ngực hoặc chụp CT và xác nhận bằng sinh thiết. Điều trị bao gồm phẫu thuật, hóa trị và xạ trị. Mặc dù có những tiến bộ trong liệu pháp, tiên lượng vẫn kém và cần tập trung vào việc phát hiện sớm và phòng ngừa.
Nguyên nhân ung thư phổi
Hút thuốc lá, bao gồm cả hút thuốc thụ động, là nguyên nhân quan trọng nhất gây ung thư phổi. Nguy cơ phụ thuộc vào độ tuổi, cường độ và thời gian hút thuốc; nguy cơ giảm sau khi cai thuốc nhưng có thể không bao giờ trở lại mức ban đầu. Ở những người không hút thuốc, yếu tố rủi ro môi trường quan trọng nhất là tiếp xúc với radon, một sản phẩm phân hủy của radium và urani tự nhiên. Các mối nguy hiểm nghề nghiệp bao gồm tiếp xúc với radon (thợ mỏ urani); amiăng (công nhân xây dựng và phá dỡ, thợ sửa ống nước, thợ đóng tàu và thợ sửa ô tô); thạch anh (thợ mỏ và thợ phun cát); asen (lò luyện đồng, nhà sản xuất thuốc trừ sâu và nhà sản xuất sản phẩm bảo vệ thực vật); các dẫn xuất của crom (nhà sản xuất thép không gỉ và nhà sản xuất bột màu); niken (nhà sản xuất pin và nhà sản xuất thép không gỉ); ete cloromethyl; khí thải lò nung berili và than cốc (ở công nhân thép), chỉ chiếm một số ít trường hợp mỗi năm. Nguy cơ mắc khối u ác tính ở hệ hô hấp cao hơn khi kết hợp các mối nguy hiểm nghề nghiệp và hút thuốc lá so với khi chỉ có một trong hai yếu tố này. COPD và xơ phổi có thể làm tăng nguy cơ; Bổ sung beta-carotene có thể làm tăng nguy cơ ở người hút thuốc. Ô nhiễm không khí và khói xì gà chứa chất gây ung thư, nhưng vai trò của chúng trong sự phát triển của ung thư phổi vẫn chưa được chứng minh.
Triệu chứng ung thư phổi
Khoảng 25% trong số tất cả các trường hợp mắc bệnh này không có triệu chứng và được phát hiện tình cờ trong quá trình khám ngực. Các triệu chứng của ung thư phổi bao gồm các biểu hiện tại chỗ của khối u, sự lan rộng tại chỗ và di căn. Các hội chứng cận ung thư và các biểu hiện chung có thể xảy ra ở bất kỳ giai đoạn nào.
Các triệu chứng tại chỗ bao gồm ho và ít gặp hơn là khó thở do tắc nghẽn đường thở, xẹp phổi sau tắc nghẽn và lan truyền bạch huyết. Sốt có thể xảy ra khi phát triển viêm phổi sau tắc nghẽn. Có tới một nửa số bệnh nhân phàn nàn về cơn đau ngực mơ hồ hoặc khu trú. Ho ra máu ít gặp hơn và mất máu rất ít, ngoại trừ trong những trường hợp hiếm hoi khi khối u làm vỡ động mạch chính, gây xuất huyết ồ ạt và tử vong do ngạt thở.
Sự lan rộng khu vực có thể gây đau màng phổi hoặc khó thở do phát triển tràn dịch màng phổi, khó thở do khối u xâm lấn dây thần kinh thanh quản quặt ngược và khó thở và thiếu oxy do liệt cơ hoành khi dây thần kinh hoành bị ảnh hưởng.
Chèn ép hoặc xâm lấn tĩnh mạch chủ trên (hội chứng tĩnh mạch chủ trên) có thể gây đau đầu hoặc cảm giác đầy đầu, sưng mặt hoặc các chi trên, khó thở và đỏ bừng (phồng rộp) khi nằm ngửa. Các biểu hiện của hội chứng tĩnh mạch chủ trên bao gồm sưng mặt và các chi trên, giãn tĩnh mạch cảnh và tĩnh mạch dưới da ở mặt và thân trên, và đỏ bừng mặt và thân trên. Hội chứng tĩnh mạch chủ trên phổ biến hơn ở những bệnh nhân có loại tế bào nhỏ.
Khối u đỉnh, thường không phải tế bào nhỏ, có thể xâm lấn đám rối thần kinh cánh tay, màng phổi hoặc xương sườn, gây đau vai và chi trên, yếu hoặc teo một cánh tay (u Pancoast). Hội chứng Horner (sa cơ, co đồng tử, không có nhãn cầu và không có mồ hôi) xảy ra khi chuỗi giao cảm cạnh đốt sống hoặc hạch sao cổ bị ảnh hưởng. Sự mở rộng màng ngoài tim có thể không có triệu chứng hoặc dẫn đến viêm màng ngoài tim co thắt hoặc chèn ép tim. Trong một số trường hợp hiếm gặp, chèn ép thực quản dẫn đến chứng khó nuốt.
Di căn cuối cùng luôn gây ra các biểu hiện liên quan đến vị trí của chúng. Di căn gan gây ra các triệu chứng đường tiêu hóa và cuối cùng là suy gan. Di căn não gây ra các rối loạn hành vi, mất trí nhớ, mất ngôn ngữ, co giật, liệt hoặc tê liệt, buồn nôn và nôn, và cuối cùng là hôn mê và tử vong. Di căn xương gây ra cơn đau dữ dội và gãy xương bệnh lý. Các khối u ác tính của hệ hô hấp thường di căn đến tuyến thượng thận, nhưng hiếm khi dẫn đến suy tuyến thượng thận.
Hội chứng cận u không phải do ung thư gây ra trực tiếp. Các hội chứng cận u thường gặp ở bệnh nhân bao gồm tăng canxi huyết (do khối u sản xuất protein liên quan đến hormone tuyến cận giáp), hội chứng tiết hormone chống bài niệu không phù hợp (SIADH), ngón tay dùi trống có hoặc không kèm theo bệnh xương khớp phì đại, tăng đông máu với viêm tắc tĩnh mạch nông di trú (hội chứng Trousseau), nhược cơ (hội chứng Eaton-Lambert) và nhiều hội chứng thần kinh khác bao gồm bệnh thần kinh, bệnh não, viêm não, bệnh tủy và tổn thương tiểu não. Cơ chế phát triển các hội chứng thần kinh cơ liên quan đến việc khối u biểu hiện các tự kháng nguyên với sự hình thành các tự kháng thể, nhưng nguyên nhân của hầu hết các hội chứng khác vẫn chưa được biết rõ.
Các triệu chứng chung thường bao gồm sụt cân, khó chịu và đôi khi là dấu hiệu đầu tiên của bệnh ác tính.
Nó bị đau ở đâu?
Giai đoạn
| Khối u nguyên phát | |
| Đây là | Ung thư biểu mô tại chỗ |
| T1 | Khối u < 3 cm không xâm lấn, nằm gần phế quản thùy (tức là không ở phế quản chính) |
| T2 | Khối u có bất kỳ đặc điểm nào sau đây: >3cm Liên quan đến phế quản chính cách carina >2cm Xâm lấn màng phổi tạng Xẹp phổi hoặc viêm phổi sau tắc nghẽn lan rộng đến đỉnh phổi nhưng không liên quan đến toàn bộ phổi |
| TZ | Khối u có bất kỳ kích thước nào với bất kỳ đặc điểm nào sau đây: Xâm lấn thành ngực (bao gồm cả tổn thương rãnh trên), cơ hoành, màng phổi trung thất hoặc màng ngoài tim thành Liên quan đến phế quản gốc cách carina < 2 cm nhưng không liên quan đến carina Xẹp phổi hoặc viêm phổi sau tắc nghẽn toàn bộ phổi |
| T4 | Khối u có bất kỳ kích thước nào với bất kỳ đặc điểm nào sau đây: Xâm lấn trung thất, tim, mạch máu lớn, khí quản, thực quản, thân đốt sống, carina Tràn dịch màng phổi hoặc màng ngoài tim ác tính Các nốt vệ tinh của khối u trong cùng một thùy với khối u chính |
| Hạch bạch huyết khu vực (N) | |
| Số 0 | Không có di căn đến hạch bạch huyết khu vực |
| N1 | Di căn đơn phương đến các hạch bạch huyết quanh phế quản và/hoặc các hạch bạch huyết của gốc phổi và các hạch bạch huyết trong phổi nằm trên đường lan truyền trực tiếp của khối u nguyên phát |
| N2 | Di căn đơn phương đến hạch trung thất và/hoặc hạch dưới carina |
| N3 | Di căn đến hạch trung thất đối diện, hạch rễ đối diện, cơ thang của hạch bạch huyết bên tương ứng hoặc hạch bạch huyết đối diện hoặc thượng đòn |
| Di căn xa (M) | |
| M0 | Không có di căn xa |
| M1 | Có di căn xa (bao gồm các hạch di căn ở thùy của bên tương ứng nhưng không phải là khối u chính) |
| Giai đoạn 0 Tis IA T1 N0 M0 IB T2 N0 M0 IIA T1 N1 M0 |
Giai đoạn IIB T2N1 M0 hoặc T3 N0 M0 IIIA T3 N1 M0 hoặc TI-3 N2 M0 IIIB Bất kỳ TN M0 hoặc T4 bất kỳ N M0 IV bất kỳ T bất kỳ N M1 |
Các hình thức
Ác tính
- Ung thư biểu mô
- Tế bào nhỏ
- Tế bào yến mạch
- Tế bào chuyển tiếp
- hỗn hợp
- Tế bào không nhỏ
- Ung thư biểu mô tuyến
- Acinar
- Tiểu phế quản phế nang
- Nhú
- Chất rắn
- Adenosquamous
- Tế bào lớn
- Tế bào trong suốt
- Tế bào khổng lồ
- Tế bào vảy
- Tế bào trục chính
- Ung thư tuyến phế quản
- Nang VA
- Mucoepidermoid
- Ung thư biểu mô
- U lympho
- Bệnh Hodgkin phổi nguyên phát
- Bệnh phổi không Hodgkin nguyên phát
Lành tính
- Thanh quản khí quản phế quản
- U tuyến
- U mô thừa
- U nguyên bào cơ
- U nhú
- Nhu mô
- U xơ
- U mô thừa
- U cơ trơn
- U mỡ
- U xơ thần kinh/u tế bào Schwann
- U máu xơ cứng
Sự chuyển đổi ác tính của các tế bào biểu mô hô hấp đòi hỏi phải tiếp xúc lâu dài với các chất gây ung thư và tích tụ nhiều đột biến gen. Các đột biến ở các gen kích thích sự phát triển của tế bào (K-RAS, MYC), mã hóa các thụ thể yếu tố tăng trưởng (EGFR, HER2/neu) và ức chế apoptosis (BCL-2) góp phần vào sự tăng sinh của các tế bào bệnh lý. Các đột biến ức chế các gen ức chế khối u (p53, APC) cũng có tác dụng tương tự. Khi các đột biến này tích tụ đủ, các khối u ác tính của các cơ quan hô hấp sẽ phát triển.
Ung thư phổi thường được chia thành ung thư phổi tế bào nhỏ (SCLC) và ung thư phổi không phải tế bào nhỏ (NSCLC). Ung thư phổi tế bào nhỏ là khối u rất hung hãn, hầu như luôn xảy ra ở người hút thuốc và gây di căn lan rộng ở 60% bệnh nhân vào thời điểm chẩn đoán. Các triệu chứng của loại không phải tế bào nhỏ thay đổi nhiều hơn và phụ thuộc vào loại mô học.
Các biến chứng và hậu quả
Điều trị tràn dịch màng phổi ác tính bắt đầu bằng chọc hút màng phổi. Tràn dịch không triệu chứng không cần điều trị; tràn dịch có triệu chứng tái phát mặc dù đã chọc hút màng phổi nhiều lần được dẫn lưu qua ống dẫn lưu ngực. Tiêm bột talc (hoặc đôi khi là tetracycline hoặc bleomycin) vào khoang màng phổi (một thủ thuật gọi là làm dính màng phổi) gây xơ cứng màng phổi, loại bỏ khoang màng phổi và có hiệu quả trong hơn 90% các trường hợp.
Điều trị hội chứng tĩnh mạch chủ trên tương tự như điều trị ung thư phổi: hóa trị, xạ trị hoặc cả hai. Glucocorticoid thường được sử dụng, nhưng hiệu quả của chúng vẫn chưa được chứng minh. Các khối u đỉnh được điều trị bằng phẫu thuật có hoặc không có xạ trị trước phẫu thuật hoặc xạ trị có hoặc không có hóa trị bổ trợ. Điều trị hội chứng cận ung thư phụ thuộc vào tình trạng cụ thể.
Chẩn đoán ung thư phổi
Xét nghiệm đầu tiên là chụp X-quang ngực. Xét nghiệm này có thể cho thấy rõ những bất thường cụ thể, chẳng hạn như thâm nhiễm đơn lẻ hoặc nhiều thâm nhiễm hoặc một nốt phổi biệt lập, hoặc những thay đổi tinh tế hơn, chẳng hạn như màng phổi liên thùy phổi dày lên, trung thất mở rộng, hẹp khí quản phế quản, xẹp phổi, thâm nhiễm nhu mô không hồi phục, tổn thương dạng hang hoặc lắng đọng hoặc tràn dịch màng phổi không rõ nguyên nhân. Những phát hiện này đáng ngờ nhưng không chẩn đoán được ung thư phổi và cần đánh giá thêm bằng CT độ phân giải cao (HRCT) và xác nhận tế bào học.
CT có thể tiết lộ nhiều cấu trúc và thay đổi đặc trưng giúp xác nhận chẩn đoán. CT cũng có thể được sử dụng để thực hiện sinh thiết kim các tổn thương có thể tiếp cận và cũng quan trọng trong việc xác định giai đoạn.
Các kỹ thuật chẩn đoán dựa trên tế bào hoặc mô phụ thuộc vào tính khả dụng của mô và vị trí của các tổn thương. Xét nghiệm đờm hoặcdịch màng phổi là phương pháp ít xâm lấn nhất. Ở những bệnh nhân ho có đờm, mẫu đờm lấy khi thức dậy có thể chứa nồng độ tế bào ác tính cao, nhưng hiệu quả của phương pháp này chỉ dưới 50%. Dịch màng phổi là một nguồn tế bào thuận tiện khác, nhưng tràn dịch xảy ra ở chưa đến một phần ba các trường hợp; tuy nhiên, sự hiện diện của tràn dịch ác tính chỉ ra bệnh ít nhất là giai đoạn IIIB và là dấu hiệu tiên lượng kém. Nhìn chung, có thể giảm thiểu kết quả tế bào học âm tính giả bằng cách lấy thể tích đờm hoặc dịch lớn nhất có thể vào đầu ngày và vận chuyển mẫu đến phòng xét nghiệm ngay lập tức để giảm sự chậm trễ trong quá trình xử lý dẫn đến sự phá vỡ tế bào. Sinh thiết qua da là thủ thuật ít xâm lấn tiếp theo. Xét nghiệm này có tầm quan trọng lớn hơn trong chẩn đoán các vị trí di căn (hạch thượng đòn hoặc các hạch bạch huyết ngoại vi khác, màng phổi, gan và tuyến thượng thận) so với các tổn thương phổi do có 20-25% nguy cơ phát triển tràn khí màng phổi và nguy cơ kết quả âm tính giả không có khả năng thay đổi các chiến thuật điều trị đã áp dụng.
Nội soi phế quản là thủ thuật thường được sử dụng nhất để chẩn đoán. Về mặt lý thuyết, phương pháp lựa chọn để lấy mô là phương pháp ít xâm lấn nhất. Trong thực tế, nội soi phế quản thường được thực hiện bổ sung hoặc thay thế cho các thủ thuật ít xâm lấn hơn vì hiệu quả chẩn đoán cao hơn và vì nội soi phế quản rất quan trọng để phân loại giai đoạn. Sự kết hợp của xét nghiệm rửa, sinh thiết bằng bàn chải và chọc hút kim nhỏ các tổn thương nội phế quản có thể nhìn thấy và các hạch bạch huyết quanh khí quản, dưới carina, trung thất và rốn phổi cho phép chẩn đoán trong 90–100% các trường hợp.
Nội soi trung thất là một thủ thuật có nguy cơ cao hơn, thường được sử dụng trước khi phẫu thuật để xác nhận hoặc loại trừ sự hiện diện của khối u trong các hạch trung thất to có hình dạng không chắc chắn.
Sinh thiết phổi mở được thực hiện thông qua phẫu thuật mở lồng ngực hoặc nội soi video được chỉ định khi các phương pháp ít xâm lấn hơn không đưa ra được chẩn đoán ở những bệnh nhân có đặc điểm lâm sàng và dữ liệu chụp X-quang cho thấy rõ sự hiện diện của khối u có thể cắt bỏ.
 [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ]
[ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ]
Xác định dàn dựng
Ung thư phổi tế bào nhỏ được phân loại là bệnh giai đoạn giới hạn hoặc tiến triển. Giai đoạn giới hạn là khối u giới hạn ở một bên ngực (bao gồm cả hạch bạch huyết đơn phương) có thể được điều trị bằng một vị trí xạ trị chấp nhận được, loại trừ sự hiện diện của tràn dịch màng phổi hoặc màng ngoài tim. Bệnh giai đoạn tiến triển là khối u ở cả hai bên ngực và sự hiện diện của tràn dịch màng phổi hoặc màng ngoài tim ác tính. Khoảng một phần ba bệnh nhân ung thư phổi tế bào nhỏ có bệnh giới hạn; phần còn lại thường có di căn xa rộng.
Phân loại ung thư phổi không phải tế bào nhỏ bao gồm việc xác định kích thước, vị trí của khối u, hạch bạch huyết và sự có hoặc không có di căn xa.
Chụp cắt lớp mỏng từ cổ đến bụng trên (để phát hiện di căn cổ, thượng đòn, gan và tuyến thượng thận) là xét nghiệm đầu tay cho cả ung thư phổi tế bào nhỏ và không phải tế bào nhỏ. Tuy nhiên, chụp cắt lớp thường không phân biệt được giữa tình trạng phì đại hạch bạch huyết trong ngực sau viêm và ác tính, hoặc giữa tổn thương gan hoặc tuyến thượng thận lành tính và ác tính (những phân biệt xác định giai đoạn của bệnh). Do đó, các xét nghiệm khác thường được thực hiện nếu phát hiện chụp cắt lớp ở những vùng này bất thường.
Chụp cắt lớp phát xạ positron (PET) là một kỹ thuật chính xác, không xâm lấn được sử dụng để xác định các hạch trung thất ác tính và các di căn xa khác (nhắm mục tiêu chuyển hóa). PET-CT tích hợp, trong đó PET và CT được kết hợp thành một hình ảnh duy nhất bằng các máy quét cùng vị trí, chính xác hơn trong việc xác định giai đoạn bệnh không phải tế bào nhỏ so với CT hoặc PET đơn lẻ hoặc so với tương quan trực quan của hai nghiên cứu. Việc sử dụng PET và CT-PET bị hạn chế bởi chi phí và tính khả dụng. Khi không có PET, nội soi phế quản và ít phổ biến hơn là nội soi trung thất hoặc nội soi ngực hỗ trợ video có thể được sử dụng để thực hiện sinh thiết các hạch trung thất nghi vấn. Nếu không có PET, các khối u gan hoặc tuyến thượng thận đáng ngờ nên được đánh giá bằng sinh thiết kim.
Chụp MRI ngực có độ chính xác cao hơn một chút so với chụp CT độ phân giải cao ở phần trên ngực trong việc chẩn đoán khối u đỉnh hoặc khối u gần cơ hoành.
Bệnh nhân bị đau đầu hoặc khiếm khuyết thần kinh nên chụp CT hoặc MRI vùng đầu và đánh giá hội chứng tĩnh mạch chủ trên. Bệnh nhân bị đau xương hoặc tăng canxi huyết thanh hoặc phosphatase kiềm nên chụp xạ hình xương. Các xét nghiệm này không được chỉ định nếu không có triệu chứng, dấu hiệu hoặc bất thường trong xét nghiệm đáng ngờ. Các xét nghiệm máu khác, chẳng hạn như công thức máu toàn phần, albumin huyết thanh và creatinine, không có vai trò trong việc xác định giai đoạn nhưng cung cấp thông tin tiên lượng quan trọng về khả năng chịu đựng điều trị của bệnh nhân.
Những gì cần phải kiểm tra?
Làm thế nào để kiểm tra?
Những bài kiểm tra nào là cần thiết?
Điều trị ung thư phổi
Điều trị ung thư phổi thường bao gồm đánh giá tính khả thi của phẫu thuật, sau đó là phẫu thuật, hóa trị và/hoặc xạ trị tùy thuộc vào loại khối u và giai đoạn. Nhiều yếu tố không liên quan đến khối u có thể ảnh hưởng đến tính khả thi của phẫu thuật. Dự trữ tim phổi kém; suy dinh dưỡng; tình trạng thể chất kém; các bệnh đi kèm bao gồm giảm tế bào máu; và suy giảm tâm thần hoặc nhận thức có thể dẫn đến việc lựa chọn liệu pháp giảm nhẹ thay vì liệu pháp chuyên sâu, hoặc không điều trị gì cả, mặc dù về mặt kỹ thuật có thể chữa khỏi.
Phẫu thuật chỉ được thực hiện khi bệnh nhân có đủ dự trữ phổi sau khi cắt bỏ thùy phổi hoặc toàn bộ phổi. Bệnh nhân có thể tích thở ra gắng sức trong 1 giây (FEV1) trước phẫu thuật lớn hơn 2 L thường phải cắt bỏ phổi. Bệnh nhân có FEV1 dưới 2 L nên tiến hành quét tưới máu bằng chất phóng xạ định lượng để xác định lượng chức năng mất đi mà bệnh nhân có thể gặp phải do cắt bỏ. FEV1 sau phẫu thuật có thể được dự đoán bằng cách nhân phần trăm tưới máu của phổi không cắt bỏ với FEV1 trước phẫu thuật. FEV1 dự đoán > 800 mL hoặc > 40% FEV1 bình thường cho thấy chức năng phổi sau phẫu thuật đủ, mặc dù các nghiên cứu về phẫu thuật giảm thể tích phổi ở bệnh nhân COPD cho thấy bệnh nhân có FEV1 < 800 mL có thể chịu được việc cắt bỏ nếu tổn thương nằm ở các vùng bóng nước kém chức năng (thường là đỉnh phổi). Bệnh nhân cắt bỏ tại các bệnh viện có tần suất phẫu thuật cao có ít biến chứng hơn và có nhiều khả năng sống sót hơn so với bệnh nhân được phẫu thuật tại các bệnh viện ít kinh nghiệm phẫu thuật hơn.
Nhiều phác đồ hóa trị đã được phát triển để điều trị; không có phác đồ nào được chứng minh là tốt hơn. Do đó, việc lựa chọn phác đồ thường phụ thuộc vào kinh nghiệm tại địa phương, chống chỉ định và độc tính của thuốc. Việc lựa chọn thuốc cho tái phát sau khi điều trị phụ thuộc vào vị trí và bao gồm hóa trị lặp lại cho tái phát tại chỗ, xạ trị cho di căn và xạ trị gần cho bệnh nội phế quản khi không thể chiếu xạ ngoài bổ sung.
Xạ trị có nguy cơ phát triển viêm phổi do xạ trị khi các vùng lớn của phổi tiếp xúc với liều lượng bức xạ cao trong thời gian dài. Viêm phổi do xạ trị có thể xảy ra trong vòng 3 tháng sau khi điều trị. Ho, khó thở, sốt nhẹ hoặc đau màng phổi có thể báo hiệu sự phát triển của tình trạng này, cũng như thở khò khè hoặc tiếng cọ xát màng phổi. Chụp X-quang ngực có thể không xác định; CT có thể cho thấy thâm nhiễm mơ hồ mà không có khối u riêng biệt. Chẩn đoán thường được đưa ra bằng cách loại trừ. Viêm phổi do xạ trị được điều trị bằng prednisolone 60 mg trong 2 đến 4 tuần, sau đó giảm dần.
Vì nhiều bệnh nhân tử vong, nên việc chăm sóc trước khi tử vong là điều cần thiết. Các triệu chứng khó thở, đau, lo lắng, buồn nôn và chán ăn là phổ biến nhất và có thể được điều trị bằng morphine tiêm; thuốc opioid dạng uống, dạng bôi ngoài da hoặc dạng tiêm; và thuốc chống nôn.
Điều trị ung thư phổi tế bào nhỏ
Ung thư phổi tế bào nhỏ ở bất kỳ giai đoạn nào thường nhạy cảm với liệu pháp điều trị ban đầu, nhưng điều này chỉ kéo dài trong thời gian ngắn. Phẫu thuật thường không có vai trò trong điều trị ung thư phổi tế bào nhỏ, mặc dù nó có thể là một lựa chọn ở những bệnh nhân hiếm hoi có khối u nhỏ ở trung tâm không lan rộng (chẳng hạn như một nốt phổi đơn độc, biệt lập).
Trong giai đoạn bệnh giới hạn, bốn liệu trình điều trị kết hợp với etoposide và một tác nhân platinum (cisplatin hoặc carboplatin) có lẽ là phác đồ hiệu quả nhất, mặc dù sự kết hợp với các tác nhân khác, bao gồm vinca alkaloid (vinblastine, vincristine, vinorelbine), tác nhân alkyl hóa (cyclophosphamide, isophosphamide), doxorubicin, taxane (docetaxel, paclitaxel) và gemcitabine, cũng thường được sử dụng. Xạ trị cải thiện thêm phản ứng; định nghĩa về bệnh giới hạn là giới hạn ở một nửa ngực dựa trên lợi ích sống sót đáng kể được thấy với xạ trị. Một số chuyên gia đề xuất chiếu xạ sọ để ngăn ngừa di căn não; di căn vi thể thường gặp ở ung thư phổi tế bào nhỏ và thuốc hóa trị không vượt qua hàng rào máu não.
Ở giai đoạn tiến triển, phương pháp điều trị giống như giai đoạn giới hạn, nhưng không có xạ trị đồng thời. Thay thế etoposide bằng thuốc ức chế topoisomerase (irinotecan hoặc topotecan) có thể cải thiện khả năng sống sót. Những loại thuốc này, dùng riêng lẻ hoặc kết hợp với các loại thuốc khác, cũng thường được sử dụng trong bệnh kháng trị và trong các bệnh ác tính đường hô hấp tái phát ở bất kỳ giai đoạn nào. Xạ trị thường được sử dụng như một phương pháp điều trị giảm nhẹ cho di căn xương hoặc não.
Nhìn chung, ung thư phổi tế bào nhỏ có tiên lượng xấu, mặc dù những bệnh nhân có tình trạng sức khỏe tốt nên được tham gia thử nghiệm lâm sàng.
Điều trị ung thư phổi không phải tế bào nhỏ
Điều trị ung thư phổi không phải tế bào nhỏ phụ thuộc vào giai đoạn bệnh. Đối với giai đoạn I và II, tiêu chuẩn là cắt bỏ bằng phẫu thuật với cắt thùy phổi hoặc cắt phổi, kết hợp với nạo hạch trung thất chọn lọc hoặc toàn bộ. Các cắt bỏ nhỏ hơn, bao gồm cắt phân đoạn và cắt nêm, được xem xét cho những bệnh nhân có dự trữ phổi kém. Phẫu thuật có hiệu quả chữa khỏi ở khoảng 55-75% bệnh nhân giai đoạn I và 35-55% bệnh nhân giai đoạn II. Hóa trị bổ trợ có thể có hiệu quả trong giai đoạn đầu của bệnh (Ib và II). Cải thiện tỷ lệ sống sót chung sau 5 năm (69% so với 54%) và tỷ lệ sống sót không tiến triển (61% so với 49%) được thấy với cisplatin cộng với vinorelbine. Vì sự cải thiện là nhỏ, nên quyết định sử dụng hóa trị bổ trợ nên được đưa ra trên cơ sở cá nhân. Vai trò của hóa trị tân bổ trợ ở giai đoạn đầu đang trong các thử nghiệm giai đoạn I.
Bệnh giai đoạn III được đặc trưng bởi một hoặc nhiều khối u tiến triển tại chỗ có liên quan đến hạch bạch huyết khu vực nhưng không có di căn xa. Đối với bệnh giai đoạn IIIA có di căn hạch bạch huyết trung thất tiềm ẩn được phát hiện khi phẫu thuật, cắt bỏ cung cấp tỷ lệ sống sót sau 5 năm là 20-25%. Xạ trị có hoặc không có hóa trị được coi là tiêu chuẩn cho bệnh giai đoạn IIIA không thể cắt bỏ, nhưng tỷ lệ sống sót là thấp (tỷ lệ sống sót trung bình là 10-14 tháng). Các nghiên cứu gần đây đã chỉ ra kết quả tốt hơn một chút với hóa trị trước phẫu thuật cộng với xạ trị và hóa trị sau phẫu thuật. Đây vẫn là một lĩnh vực cần nghiên cứu thêm.
Giai đoạn IIIB với sự tham gia của hạch bạch huyết trung thất đối bên hoặc thượng đòn hoặc tràn dịch màng phổi ác tính đòi hỏi phải xạ trị, hóa trị hoặc cả hai. Việc bổ sung các tác nhân hóa trị liệu nhạy cảm với tia xạ như cisplatin, paclitaxel, vincristine và cyclophosphamide cải thiện đôi chút khả năng sống sót. Bệnh nhân có khối u tiến triển tại chỗ liên quan đến tim, mạch máu lớn, trung thất hoặc cột sống thường được điều trị bằng xạ trị. Hiếm khi (T4N0M0), cắt bỏ bằng phẫu thuật kết hợp hóa xạ trị tân bổ trợ hoặc bổ trợ có thể khả thi. Tỷ lệ sống sót sau 5 năm đối với bệnh nhân được điều trị ở giai đoạn IIIB là 5%.
Mục tiêu của liệu pháp điều trị ung thư phổi giai đoạn IV là làm giảm các triệu chứng. Hóa trị và xạ trị có thể được sử dụng để thu nhỏ khối u, điều trị các triệu chứng và cải thiện chất lượng cuộc sống. Tuy nhiên, thời gian sống trung bình là dưới 9 tháng; dưới 25% bệnh nhân sống sót sau 1 năm. Các thủ thuật phẫu thuật giảm nhẹ bao gồm chọc hút màng phổi và làm dính màng phổi đối với tràn dịch tái phát, đặt ống thông dẫn lưu màng phổi, phá hủy mô khối u bằng nội soi phế quản liên quan đến khí quản và phế quản chính, đặt stent để ngăn ngừa tắc nghẽn đường thở và trong một số trường hợp, ổn định cột sống để ngăn ngừa chèn ép tủy sống.
Một số tác nhân sinh học mới nhắm vào khối u. Gefitinib, một chất ức chế tyrosine kinase thụ thể yếu tố tăng trưởng biểu bì (EGFR), có thể được sử dụng ở những bệnh nhân không đáp ứng với platinum và docetaxel. Các tác nhân sinh học khác trong các thử nghiệm giai đoạn I bao gồm các chất ức chế EGFR khác, oligonucleotide mRNA anti-EGFR (RNA thông tin) và chất ức chế farnesyl transferase.
Điều quan trọng là phải phân biệt giữa tái phát loại không phải tế bào nhỏ, khối u nguyên phát thứ hai độc lập, ung thư phổi không phải tế bào nhỏ tái phát tại chỗ và di căn xa. Điều trị khối u nguyên phát thứ hai độc lập và tái phát loại bệnh không phải tế bào nhỏ được thực hiện theo cùng các nguyên tắc áp dụng cho khối u nguyên phát ở giai đoạn I-III. Nếu phẫu thuật được sử dụng ban đầu, thì phương pháp chính là xạ trị. Nếu tái phát biểu hiện dưới dạng di căn xa, bệnh nhân được điều trị như ở giai đoạn IV với trọng tâm là các thủ thuật giảm nhẹ.
Trong một loạt các biện pháp điều trị, việc tuân thủ chế độ ăn uống cho bệnh nhân ung thư phổi là rất quan trọng.
Thông tin thêm về cách điều trị
Phòng ngừa
Ung thư phổi chỉ có thể được ngăn ngừa bằng cách ngừng hút thuốc. Không có biện pháp can thiệp tích cực nào được chứng minh là có hiệu quả. Giảm nồng độ radon cao trong nhà sẽ loại bỏ bức xạ gây ung thư, nhưng chưa được chứng minh là làm giảm tỷ lệ mắc ung thư phổi. Việc tăng tiêu thụ trái cây và rau quả có hàm lượng retinoid và beta-carotene cao có thể không có tác dụng đối với ung thư phổi. Việc bổ sung vitamin cho người hút thuốc không có lợi ích đã được chứng minh (vitamin E) hoặc có hại (beta-carotene). Dữ liệu sơ bộ cho thấy việc bổ sung NSAID và vitamin E có thể bảo vệ những người từng hút thuốc khỏi ung thư phổi cần được xác nhận. Các phương pháp tiếp cận phân tử mới nhắm vào các con đường truyền tín hiệu tế bào và điều hòa chu kỳ tế bào, cũng như các kháng nguyên liên quan đến khối u, đang được khám phá.
Dự báo
Ung thư phổi có tiên lượng xấu, ngay cả với các liệu pháp mới hơn. Trung bình, những bệnh nhân không được điều trị mắc bệnh không phải tế bào nhỏ giai đoạn đầu sống được khoảng 6 tháng, trong khi tỷ lệ sống sót sau 5 năm đối với những bệnh nhân được điều trị là khoảng 9 tháng. Những bệnh nhân mắc bệnh tế bào nhỏ giai đoạn tiến triển có tiên lượng đặc biệt xấu, với tỷ lệ sống sót sau 5 năm dưới 1%. Tỷ lệ sống sót trung bình đối với bệnh hạn chế là 20 tháng, với tỷ lệ sống sót sau 5 năm là 20%. Ở nhiều bệnh nhân mắc ung thư phổi tế bào nhỏ, hóa trị kéo dài cuộc sống và cải thiện chất lượng cuộc sống đủ để biện minh cho việc sử dụng nó. Tỷ lệ sống sót sau 5 năm đối với những bệnh nhân mắc ung thư phổi không phải tế bào nhỏ thay đổi tùy theo giai đoạn, từ 60% đến 70% đối với những bệnh nhân ở giai đoạn I đến gần như 0% đối với những bệnh nhân ở giai đoạn IV; dữ liệu hiện có cho thấy tỷ lệ sống sót tốt hơn đối với những bệnh nhân mắc bệnh giai đoạn đầu với các phác đồ hóa trị dựa trên platinum. Với kết quả điều trị đáng thất vọng đối với căn bệnh ở giai đoạn sau, những nỗ lực nhằm giảm tỷ lệ tử vong ngày càng tập trung vào việc phát hiện sớm và các biện pháp phòng ngừa tích cực.
Chụp X-quang ngực sàng lọc ở những bệnh nhân có nguy cơ cao giúp phát hiện sớm ung thư phổi nhưng không làm giảm tỷ lệ tử vong. Chụp CT sàng lọc nhạy hơn trong việc phát hiện khối u, nhưng tỷ lệ kết quả dương tính giả cao làm tăng số lượng các thủ thuật chẩn đoán xâm lấn không cần thiết được sử dụng để xác nhận các phát hiện trên CT. Các thủ thuật như vậy rất tốn kém và có nguy cơ biến chứng. Một chiến lược chụp CT hàng năm ở những người hút thuốc, sau đó là PET hoặc CT độ phân giải cao để đánh giá các tổn thương không xác định đang được nghiên cứu. Hiện tại, chiến lược này dường như không làm giảm tỷ lệ tử vong và không thể được khuyến nghị cho thực hành thường quy. Các nghiên cứu trong tương lai có thể bao gồm sự kết hợp của phân tích phân tử các gen đánh dấu (ví dụ: K-RAS, p53, EGFR), phân tích tế bào đờm và phát hiện các hợp chất hữu cơ liên quan đến ung thư (ví dụ: ankan, benzen) trong hơi thở ra.

